Хемоглобин
Съдържание
Структура на хемоглобина
Молекулата на хемоглобина (НЬ) има сфероидна форма и размери приблизително 55 х 50 х 64 А и молекулна маса 64 458 Da. Хемоглобинът е хромопротеин. Молекулата му се изгражда от две съставки: белтъчна (глобин), която се състои от 4 полипепдидни вериги – две еднакви двойки, и небелтъчна (хем), която се представя от 4 порфиринови пръстена, по един към всяка полипептидна верига. Хемоглобинът е главната белтъчна съставка на еритроцитите. Образува се от четири субединици, образувани от по една молекула хем (Fe++) и една полипептидна верига (глобинова част).
Хемоглобинът има четири нива на структурна организация:
- Първична структура. Първичната структура се определя от вида, броя и линейната последователност на аминокиселините, които образуват полипептидната верига. Аминокиселинните остатъци са свързани с пептидни мостове. Полипептидната верига започва с N-начало (-NH2) и завършва с С-край (-СООН). През различни периоди от развитието и живота на здрави хора хемоглобинът се изгражда от различни полипептидни вериги: алфа-веригите, за разлика от β, γ и δ, участват в структурата на всички нормални хемоглобини на човека след раждането. По тази причина и поради особеностите в структурата полипептидните вериги условно се делят на алфа- и неалфа вериги. Алфа-веригите се изграждат от 141 аминокиселинни остатъка. Heалфа веригите (β, γ и δ) се образуват от по 146 аминокиселинни остатъка. Структурата на β, γ и δ-веригите е сходна. Разликите между тях се свеждат до 10 аминокиселини, което подсказва общия им произход.
- Вторична структура. Това структурно ниво се характеризира с формирането на спирални и неспирални участъци (сегменти) в полипептидната верига. Структурно спиралните участъци представляват алфа-спирали, стабилизирани с водородни мостове и обхващат около 80% от дължината на глобиновата верига. Сегментите се именуват на латиница с главни букви от А до Н. Линейните, неспирални сегменти, разположени между спиралите, съставляват 20% от веригата. Неспиралните участъци се означават с две букви – на предишния и на следващия спирален сегмент, с изключение на първия и последния неспирален участък. Алфа-веригите имат 7 спирални сегмента (А, В, С, Е, F, G, Н) и 6 неспирални (NA, АВ, СЕ, EF, GH, НС). N в NA идва от -NH2 в началото на полипептидната верига. С в НС е от карбоксилната група (-СООН) в края на веригата. Бета, гама и делта-веригите имат по 8 спирални (А, В, С, D, Е, F, G, Н) и по 6 неспирални участъка (NA, АВ, CD, EF, GH, НС).
- Третична структура. Тя се създава чрез прегъване на глобиновата верига в неспиралните участъци, в резултат на което веригата получава глобуларна форма. Всяка полипептидна верига е нагъната около себе си така, че да образува на повърхността си цепнатина (хемово джобче), в която е разположен хемът. Нормално това джобче е подплатено от неполярни (хидрофобни) аминокиселини. Аминокиселините по външната повърхност са хидрофилни, което прави молекулата водноразтворима. Хемът се закрепва в джобчето посредством координативната връзка между железния атом и имидазоловата група на проксималния хистидин на β92 или α87.Имидазоловата група на дисталния хистидин на β63 или α58 също е в съприкосновение с железния атом на хема, но вероятно тази връзка променя местоположението си, за да позволи свързването на кислород към хемоглобиновата молекула при оксигениране и отделяне от нея – при деоксигениране.
-
Четвъртична структура.
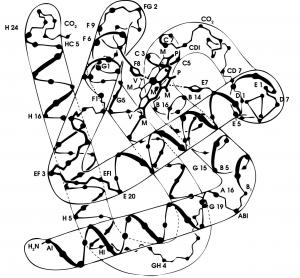 Четири полипептидни вериги (субединици) с третична структура, две по две еднакви, се свързват чрез нековалентни връзки и образуват тетрамера на хемоглобиновата молекула. Двете двойки полипептидни вериги в тетрамера са разположени така, че заграждат централната кухина на хемоглобиновата молекула. Субединиците на хемоглобина влизат в контакт помежду си в 4 точки. При НbА контактите са α1β2 и α1β1. Контактите α1β2 са по-тесни и действат като шарнири, което позволява хемоглобиновият тетрамер да се отваря и затваря подобно на мида при свързване и освобождаване на О2 от хемоглобина. Хемът е протопорфирин IX, свързан с един атом желязо във втора валенция (Fe++). Хемът придава цвета на кръвта. Железният атом в центъра на хема е от шеста координативна валентност. Четири от валентните връзки са свързани с азотните атоми на пироловите ядра, петата осигурява свързването с полипептидната верига, а шестата може да свързва обратимо О2 или СО2 в зависимост от парциалното им налягане, както и някои други газове (CO, HCN). Синтезата на полипептидните вериги на хемоглобина се определя от четири различни генома. Продуктите им се означават като алфа-, бета-, гама- и делта вериги.
Четири полипептидни вериги (субединици) с третична структура, две по две еднакви, се свързват чрез нековалентни връзки и образуват тетрамера на хемоглобиновата молекула. Двете двойки полипептидни вериги в тетрамера са разположени така, че заграждат централната кухина на хемоглобиновата молекула. Субединиците на хемоглобина влизат в контакт помежду си в 4 точки. При НbА контактите са α1β2 и α1β1. Контактите α1β2 са по-тесни и действат като шарнири, което позволява хемоглобиновият тетрамер да се отваря и затваря подобно на мида при свързване и освобождаване на О2 от хемоглобина. Хемът е протопорфирин IX, свързан с един атом желязо във втора валенция (Fe++). Хемът придава цвета на кръвта. Железният атом в центъра на хема е от шеста координативна валентност. Четири от валентните връзки са свързани с азотните атоми на пироловите ядра, петата осигурява свързването с полипептидната верига, а шестата може да свързва обратимо О2 или СО2 в зависимост от парциалното им налягане, както и някои други газове (CO, HCN). Синтезата на полипептидните вериги на хемоглобина се определя от четири различни генома. Продуктите им се означават като алфа-, бета-, гама- и делта вериги.
Заболявания
На вашето внимание
Изследвания и процедури
Състояния и заболявания
Покана
Ако сте медицински, здравен или сроден специалист и бихте желали да допринесете за подобряване качеството на тази публикация – да предложите свой собствен авторски текст, фотография или видео, или просто да ни посочите грешка от едно или друго естество, която може да сме допуснали при подготовката на материала, заповядайте!