Комирнати 30 микрограма/доза концентрат за инжекционна дисперсия, иРНК ваксина срещу COVID-19 (нуклеозидно модифицирана)
Comirnaty 30 micrograms/dose concentrate for dispersion for injection, COVID-19 mRNA Vaccine (nucleoside modified)
- Приложение при деца: Безопасността и ефикасността на Комирнати (Comirnaty) при педиатрични участници на възраст < 12 години все още не са установени
- Приложение при пациенти на(д) 65 години: Не се налага коригиране на дозата при лица ≥ 65 години
- Приложение при бременност: Приложение на Комирнати (Comirnaty) по време на бременност трябва да се обсъжда само когато потенциалните ползи надвишават всякакви потенциални рискове за майката и фетуса
- Приложение при кърмене: Не е известно дали Комирнати (Comirnaty) се екскретира в кърмата
- Приложение при опити за забременяване: Проучванията при животни не показват преки или непреки ефекти, свързани с репродуктивна токсичност
- Приложение при шофиране и работа с машини: Комирнати (Comirnaty) не повлиява или повлиява пренебрежимо способността за шофиране и работа с машини
Фармакодинамика
Нуклеозидно модифицираната информационна РНК в Комирнати (Comirnaty) е под формата на липидни наночастици, което позволява доставянето на нереплицираща се РНК в клетките гостоприемници, за да насочи преходната експресия на S антигена на SARS-CoV-2. иРНК кодира мембранно закотвен, пълноверижен S (spike) протеин с две точкови мутации в централната част на спиралата. Мутацията на тези две аминокиселини до пролин стабилизира S (spike) протеина в антигенно предпочитана префузионна структура. Ваксината предизвиква както производство на неутрализиращи антитела, така и клетъчен имунен отговор към S (spike) антигена, което може да допринесе за защита срещу КОВИД-19 (COVID-19).
Показания
Комирнати (Comirnaty) e показана за активна имунизация за превенция на заболяването COVID-19, причинено от вируса SARS-CoV-2, на лица на възраст 12 и повече години в съответствие с официалните препоръки.
Противопоказания
Свръхчувствителност към активното вещество или към някое от помощните вещества:
- ((4-хидроксибутил)азанедиил)бис(хексан-6,1-диил)бис(2-хексилдеканоат) (ALC-0315)
- 2-[(полиетиленгликол)-2000]-N,N-дитетрадецилацетамид (ALC-0159)
- 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC)
- Холестерол
- Калиев хлорид
- Калиев дихидрогенфосфат
- Натриев хлорид
- Динатриев фосфат дихидрат
- Захароза
- Вода за инжекции
Специални предупреждения и предпазни мерки
Проследимост
За да се подобри проследимостта на биологичните лекарствени продукти, името и партидният номер на приложения продукт трябва ясно да се записват.
Общи препоръки
Свръхчувствителност и анафилаксия
Има съобщения за събития на анафилаксия. Винаги трябва да има на разположение подходящо медицинско лечение и наблюдение в случай на анафилактична реакция след приложение на ваксината.
Препоръчва се внимателно наблюдение в продължение на най-малко 15 минути след ваксинацията. Не трябва да се прилага втора доза от ваксината на лица, получили анафилаксия към първата доза Комирнати (Comirnaty).
Миокардит и перикардит
След ваксинация с Комирнати (Comirnaty) са наблюдавани много редки случаи на миокардит и перикардит. Тези случаи са настъпили предимно в рамките на 14 дни след ваксинация, по-често след втората ваксина и по-често при по-млади мъже. От наличните данни може да се предположи, че протичането на миокардит и перикардит след ваксинацията не се различава от това при миокардит или перикардит като цяло.
Медицинските специалисти трябва да бъдат бдителни за признаците и симптомите на миокардит и перикардит. Ваксинираните лица трябва да бъдат инструктирани да потърсят незабавно медицинска помощ, ако развият симптоми, показателни за миокардит или перикардит, като (остра и продължителна) болка в гърдите, задух или палпитации след ваксинацията.
Медицинските специалисти трябва да направят справка с ръководствата и/или специалистите за диагностициране и лечение на това заболяване.
Рискът от миокардит след трета доза Комирнати (Comirnaty) все още не е охарактеризиран.
Реакции, свързани с тревожност
Във връзка със самия процес на ваксинация могат да възникнат реакции, свързани с тревожност, включително вазовагални реакции (синкоп), хипервентилация или реакции, свързани със стреса (напр. замаяност, палпитации, ускорен сърдечен ритъм, промени в
кръвното налягане, усещане за изтръпване и изпотяване). Реакциите, свързани със стреса, са преходни и отзвучават от само себе си. Хората трябва да бъдат посъветвани да информират за тези симптоми ваксиниращия ги за оценка. Важно е да се вземат предпазни мерки, за да се предотврати нараняване от припадане.
Съпътстващо заболяване
Ваксинацията трябва да се отложи при лица, страдащи от остро тежко фебрилно заболяване или остра инфекция. Наличието на лека инфекция и/или невисока температура не трябва да става причина за отлагане на ваксинацията.
Тромбоцитопения и нарушения на кръвосъсирването
Както при други интрамускулни инжекции, ваксината трябва да се прилага внимателно при лица, получаващи антикоагулантна терапия, или лица с тромбоцитопения или някакво нарушение на кръвосъсирването (като хемофилия), тъй като при тези лица могат да възникнат кървене или образуване на синини след интрамускулно приложение.
Имунокомпрометирани лица
Ефикасността и безопасността на ваксината не са оценени при имунокомпрометирани лица, включително тези, получаващи имуносупресивна терапия. Ефикасността на Комирнати (Comirnaty) може да е по-ниска при имуносупресирани лица.
Препоръката да се обсъди приложение на трета доза при тежко имунокомпрометирани лица се базира на ограничени серологични данни в литературата от серия случаи от овладяването на клиничните симптоми при пациенти с ятрогенна имуносупресия след трансплантация на
солиден орган.
Продължителност на защитата
Продължителността на защитата, предоставяна от ваксината, не е известна, тъй като тя все още се определя в текущи клинични проучвания.
Ограничения на ефективността на ваксината
Както при всяка ваксина, ваксинацията с Комирнати (Comirnaty) може да не защити всички ваксинирани. Лица може да не са напълно защитени до 7-мия ден след втората доза от ваксината.
Помощни вещества
Тази ваксина съдържа по-малко от 1 mmol калий (39 mg) на доза, т.е. може да се каже, че практически не съдържа калий.
Тази ваксина съдържа по-малко от 1 mmol натрий (23 mg) на доза, т.е. може да се каже, че практически не съдържа натрий.
Приложение
Дозировка
Лица на възраст 12 и повече години
Комирнати (Comirnaty) се прилага интрамускулно след разреждане като първичен курс от 2 дози (по 0.3 ml всяка). Препоръчва се втората доза да се приложи 3 седмици след първата доза.
Бустер доза (трета доза) Комирнати (Comirnaty) може да се приложи интрамускулно най-малко 6 месеца след втората доза на лица на възраст 18 и повече години. Решението кога и на кого да се приложи трета доза Комирнати (Comirnaty) трябва да се вземе въз основа на наличните данни за ефективността на ваксината, като се имат предвид ограничените данни за безопасност.
Взаимозаменяемостта на Комирнати (Comirnaty) с други ваксини срещу COVID-19 за завършване на първичния ваксинационен курс или приложение на бустер доза (трета доза) не са установени. Лица, на които е приложена 1 доза Комирнати (Comirnaty), трябва да получат втора доза Комирнати (Comirnaty), за да завършат първичния ваксинационен курс и за да може да им бъдат прилагани допълнителни дози.
Тежко имунокомпрометирани лица на възраст 12 и повече години
На лица, които са тежко имунокомпрометирани, трета доза може да се приложи най-малко 28 дни след втората доза.
Педиатрична популация
Безопасността и ефикасността на Комирнати (Comirnaty) при педиатрични участници на възраст по-малко от 12 години все още не са установени. Налични са ограничени данни.
Популация в старческа възраст
Не се налага коригиране на дозата при лица в старческа възраст ≥ 65 години. Безопасността и имуногенността на бустер доза (трета доза) Комирнати (Comirnaty) при лица на възраст 65 и повече години се базира на данните за безопасност и имуногенност при възрастни на възраст 18 до 55 години.
Начин на приложение
Комирнати (Comirnaty) трябва да се прилага интрамускулно след разреждане.
След разреждане флаконите с Комирнати (Comirnaty) съдържат шест дози ваксина по 0.3 ml. За да се изтеглят шест дози от един флакон, трябва да се използват спринцовки и/или игли с малък (неизползваем) мъртъв обем. Комбинацията от спринцовка и игла с малък мъртъв обем трябва да има мъртъв обем не по-голям от 35 микролитра. Ако се използват стандартни спринцовки и игли, може да няма достатъчен обем за изтегляне на шест дози от един флакон. Независимо от вида на спринцовката и иглата:
- Всяка доза трябва да съдържа 0.3 ml ваксина.
- Ако количеството на останалата във флакона ваксина не може да достави една цяла доза от 0.3 ml, изхвърлете флакона и излишния обем.
- Не събирайте излишъците ваксина от няколко флакона.
Предпочитаното място е делтоидният мускул в горната част на ръката.
Не инжектирайте ваксината интраваскуларно, подкожно или интрадермално.
Ваксината не трябва да се смесва в една и съща спринцовка с други ваксини или лекарствени продукти.
Указания за работа
Комирнати (Comirnaty) трябва да се приготви от медицински специалист, като се използва асептична техника, за да се гарантира стерилността на приготвената дисперсия.
Размразяване преди разреждане
- Многодозовият флакон се съхранява замразен и трябва да се размрази преди разреждане. Замразените флакони трябва да се пренесат в среда с температура 2°C до 8°C, за да се размразят; размразяването на една опаковка със 195 флакона може да отнеме 3 часа. Възможен е също друг вариант, при който замразените флакони да се размразят за 30 минути при температура до 30°C за незабавна употреба.
- Неотвореният флакон може да се съхранява за период до 1 месец при 2°C до 8°C. В рамките на 1-месечния срок на годност при условията на съхранение от 2°C до 8°C за транспортиране може да се използват до 12 часа.
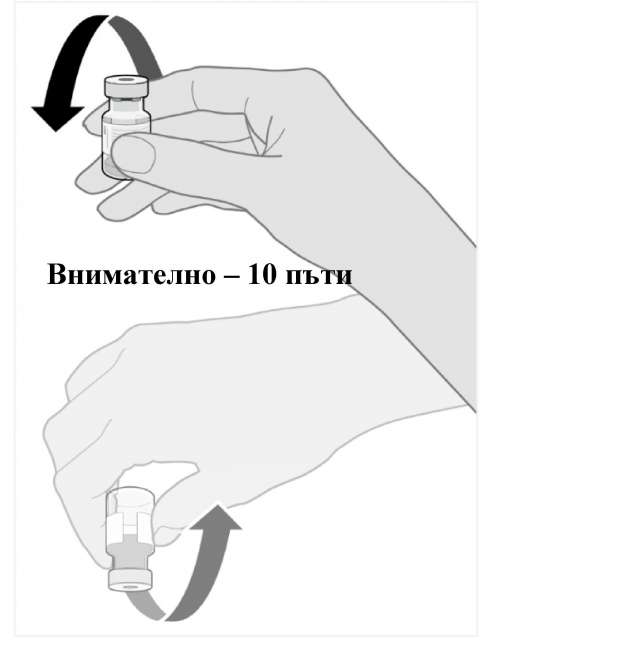
- Оставете размразения флакон да достигне стайна температура и внимателно го обърнете 10 пъти преди разреждане. Не разклащайте.
- Преди разреждане размразената дисперсия може да съдържа бели до почти бели непрозрачни аморфни частици.
Разреждане
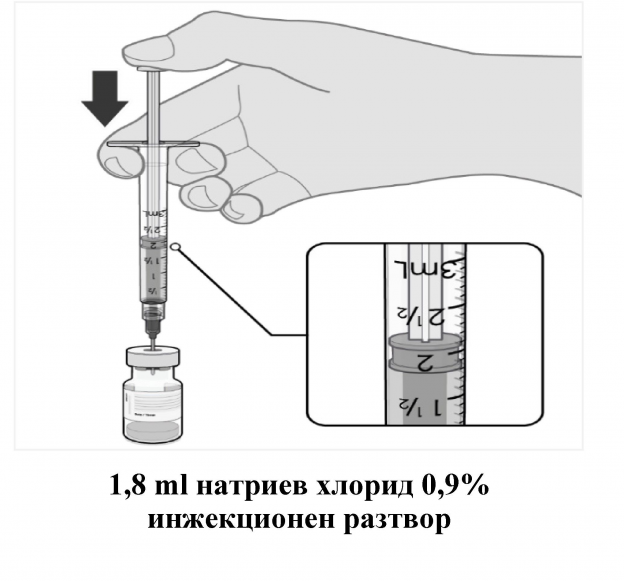
- Размразената ваксина трябва да се разреди в нейния оригинален флакон с 1.8 ml натриев хлорид 9 mg/ml (0.9%) инжекционен разтвор, като се използва игла 21 G, или по-тънка, и асептична техника.
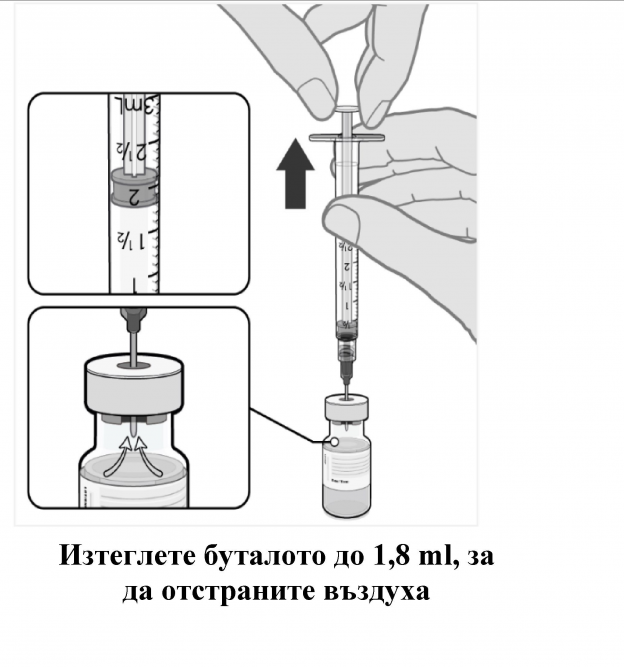
- Изравнете налягането във флакона, преди да извадите иглата от него, като изтеглите 1.8 ml въздух в изпразнената спринцовка на разредителя.
- Внимателно обърнете разредената дисперсия 10 пъти. Не разклащайте.
- Разредената ваксина трябва да представлява почти бяла дисперсия без видими частици. Не използвайте разредената ваксина при наличие на частици или промяна в цвета.
- На разредените флакони трябва да бъдат отбелязани съответните дата и час.
- След разреждане съхранявайте при 2°C до 30°C и използвайте в рамките на 6 часа, включително времето за транспортиране.
- Не замразявайте или разклащайте разредената дисперсия. Ако е била поставена в хладилник, оставете разредената дисперсия да достигне стайна температура преди употреба.
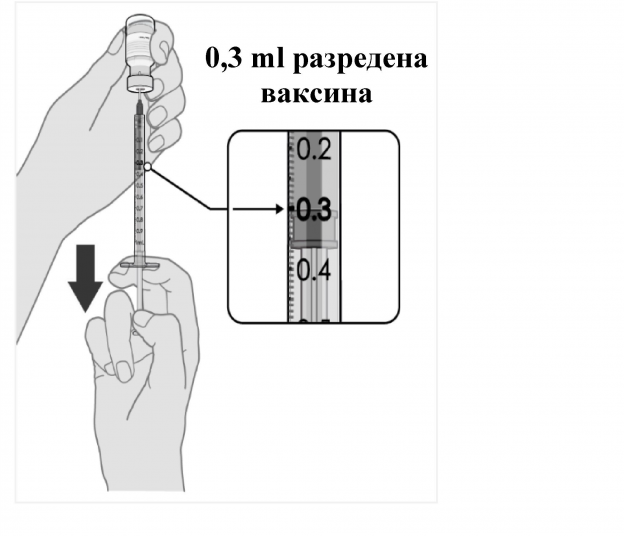
Приготвяне на индивидуални дози Комирнати (Comirnaty) от 0.3 ml
- След разреждане флаконът съдържа 2.25 ml, от които могат да се изтеглят 6 дози по 0.3 ml.
- Като използвате асептична техника, почистете запушалката на флакона с тампон за еднократна употреба, напоен с антисептичен разтвор.
- Изтеглете 0.3 ml Комирнати (Comirnaty). Трябва да се използват спринцовки и/или игли с малък мъртъв (неизползваем) обем, за да се изтеглят шест дози от един флакон. Комбинацията от спринцовка и игла с малък мъртъв обем трябва да има мъртъв обем не по-голям от 35 микролитра. Ако се използват стандартни спринцовки и игли, може да няма достатъчен обем за изтегляне на шест дози от един флакон.
- Всяка доза трябва да съдържа 0.3 ml ваксина.
- Ако количеството на останалата във флакона ваксина не може да достави една цяла доза от 0.3 ml, изхвърлете флакона и излишния обем.
- Изхвърлете неизползваната ваксина в рамките на 6 часа след разреждане.
Предозиране
В случай на предозиране се препоръчва проследяване на жизнените функции и възможно симптоматично лечение.
Срок на годност
Неотворен флакон
Замразен флакон
9 месеца при -90°C до -60°C.
В рамките на 9-месечния срок на годност неотворените флакони може да се съхраняват и транспортират при -25°C до -15°C за еднократен период до 2 седмици, след което може да се върнат обратно за съхранение при температура -90ºC до -60ºC.
Размразен флакон
1 месец при 2°C до 8°C.
В рамките на 1-месечния срок на годност при условията на съхранение от 2°C до 8°C за транспортиране може да се използват до 12 часа.
Преди употреба неотвореният флакон може да се съхранява до 2 часа при температура до 30°C.
След размразяване ваксината не трябва да се замразява отново.
Работа при температурни отклонения след изваждане от фризера
Данните за стабилност показват, че неотвореният флакон е стабилен до:
- 24 часа, когато се съхранява при температура от -3°C до 2°C;
- общо 4 часа, когато се съхранява при температура от 8°C до 30°C; това включа 2-та часа при температура до 30°C, описани по-горе.
Тази информация е предназначена да упъти медицинските специалисти само в случай на временно температурно отклонение.
Трансфер на замразени флакони, съхранявани при свръхниска температура (< -60°C)
- Плитките кутии с флакони, които са затворени с капаци, съдържащи 195 флакона, извадени от съхранение в замразено състояние при свръхниска температура (< -60°C), могат да останат на температура до 25°C не повече от 5 минути.
- Плитките кутии с флакони, на които капаците са отворени, или тези, който съдържат по-малко от 195 флакона, след като са извадени от съхранение в замразено състояние при свръхниска температура (< -60°C), могат да останат на температура до 25°C не повече от 3 минути.
- След като кутиите с флакони се върнат обратно за съхранение в замразено състояние след експозиция на температура до 25°C, те трябва да останат на съхранение в замразено състояние в продължение на най-малко 2 часа, преди да могат да бъдат извадени отново.
Трансфер на замразени флакони, съхранявани при -25°C до -15°C
- Плитките кутии с флакони, които са затворени с капаци, съдържащи 195 флакона, извадени от съхранение в замразено състояние (-25°C до -15°C), могат да останат на температура до 25°C не повече от 3 минути.
- Плитките кутии с флакони, на които капаците са отворени, или тези, които съдържат по-малко от 195 флакона, след като са извадени от съхранение в замразено състояние (-25°C до -15°C), могат да останат на температура до 25°C не повече от 1 минута.
След като веднъж даден флакон е изваден от плитката кутия с флакони, той трябва да се размрази за употреба.
Разреден лекарствен продукт
Доказана е химична и физична стабилност по време на употреба, включително по време на транспортиране, за 6 часа при 2°C до 30°C след разреждане в натриев хлорид 9 mg/ml (0.9%) инжекционен разтвор. От микробиологична гледна точка, освен ако методът на разреждане изключва риск от микробна контаминация, продуктът трябва да се използва веднага. Ако не се използва веднага, времето и условията на съхранение по време на употреба са отговорност на потребителя.
Специални условия на съхранение
Да се съхранява във фризер при -90°C до -60°C.
Да се съхранява в оригиналната опаковка, за да се предпази от светлина.
По време на съхранение сведете до минимум излагането на стайна светлина и избягвайте излагане на пряка слънчева светлина и ултравиолетова светлина.
С размразените флакони може да се работи в условия на стайна светлина.
Вид и съдържание на опаковката
Прозрачен многодозов флакон (стъкло тип I) 2 ml със запушалка (синтетична бромобутилова гума), с алуминиева обкатка и отчупващо се пластмасово капаче. Всеки флакон съдържа 6 дози.
Вид опаковка: 195 флакона.
Изхвърляне
Неизползваният лекарствен продукт или отпадъчните материали от него трябва да се изхвърлят в съответствие с местните изисквания.
Бременност
Има ограничен опит от употребата на Комирнати (Comirnaty) при бременни жени. Проучванията при животни не показват преки или непреки вредни ефекти, свързани с бременността, ембрионалното/феталното развитие, раждането или постнаталното развитие. Приложение на Комирнати (Comirnaty) по време на бременност трябва да се обсъжда само когато потенциалните ползи надвишават всякакви потенциални рискове за майката и фетуса.
Кърмене
Не е известно дали Комирнати (Comirnaty) се екскретира в кърмата.
Фертилитет
Проучванията при животни не показват преки или непреки ефекти, свързани с репродуктивна токсичност.
Шофиране и работа с машини
Комирнати (Comirnaty) не повлиява или повлиява пренебрежимо способността за шофиране и работа с машини. Все пак някои от нежеланите реакции, посочени по-долу, могат временно да повлияят способността за шофиране или работа с машини.
Взаимодействия
Не са провеждани проучвания за взаимодействията.
Съпътстващото приложение на Комирнати (Comirnaty) с други ваксини не е проучено.
Нежелани реакции
Нежеланите реакции, наблюдавани по време на клиничните проучвания, са изброени по-долу, съгласно следните категории по честота:
- Много чести (≥ 1/10),
- Чести (≥ 1/100 до < 1/10),
- Нечести (≥ 1/1000 до < 1/100),
- Редки (≥ 1/10 000 до < 1/1000),
- Много редки (< 1/10 000),
- С неизвестна честота (от наличните данни не може да бъде направена оценка).
| Системо-органен клас | Много чести (≥ 1/10) | Чести (≥ 1/100 до < 1/10) | Нечести (≥ 1/1000 до < 1/100) | Редки (≥ 1/10 000 до < 1/1000) | С неизвестна честота (от наличните данни не може да бъде направена оценка) |
|---|---|---|---|---|---|
| Нарушения на кръвта и лимфната система | Лимфаденопатияa | ||||
| Нарушения на имунната система | Реакции на свръх-чувстви-телност (напр. обрив, пруритус, уртикарияб, ангиоедемб) | Анафилаксия | |||
| Нарушения на метаболизма и храненето | Намален апетит | ||||
| Психични нарушения | Безсъние | ||||
| Нарушения на нервната система | Главоболие | Летаргия | Остра периферна лицева парализав | ||
| Сърдечни нарушения | Гадене | Миокардитг, перикардитг | |||
| Стомашно-чревни нарушения | Диарияг | Гадене, повръщанег | |||
| Нарушения на кожата и подкожната тъкан | Хиперхидроза, нощни изпотявания | ||||
| Нарушения на мускулно-скелетната система и съединителната тъкан | Артралгия, миалгия | Болка в крайникд | |||
| Общи нарушения и ефекти на мястото на приложение | Болка на мястото на инжектиране, умора, втрисане, пирексияе, оток на мястото на инжектиране | Зачервяване на мястото на инжектиране | Астения, неразположение, пруритус на мястото на инжектиране | Обширен оток на ваксинирания крайникг, оток на лицетож | |
| a По-голяма честота на лимфаденопатия (5.2% спрямо 0.4%) е наблюдавана при участници, получили бустер доза (трета доза), в сравнение с участници, получили 2 дози. | |||||
| б Категорията по честота за уртикария и ангиоедем е „Редки“. | |||||
| в През периода на проследяването за безопасност на клиничното проучване, до 14 ноември 2020 г., остра периферна лицева парализа е съобщена от четирима участници в групата на иРНК ваксината срещу COVID-19. Появата на лицева парализа е на ден 37 след доза 1 (доза 2 не е приложена на участника) и дни 3, 9 и 48 след доза 2. Няма съобщения за случаи на остра периферна лицева парализа в групата на плацебо. | |||||
| г Нежелана реакция, установена след разрешаване за употреба. | |||||
| д Отнася се за ръката, на която е поставена ваксината. | |||||
| е По-голяма честота на пирексия е наблюдавана след втората доза в сравнение с първата доза. | |||||
| ж Съобщава се за оток на лицето при реципиенти на ваксината, на които е бил инжектиран дермален филър през постмаркетинговия период. | |||||
- Производител/Вносител:
- Показания:
Покана
Ако сте медицински, здравен или сроден специалист и бихте желали да допринесете за подобряване качеството на тази публикация – да предложите свой собствен авторски текст, фотография или видео, или просто да ни посочите грешка от едно или друго естество, която може да сме допуснали при подготовката на материала, заповядайте!